密闭环境细胞迁移和核膜破裂自动分析系统,受限制环境细胞迁移和核膜破裂自动分析系统 系统背景: 近的体外和体内研究强调了细胞核在控制有限环境中迁移方面的重要性。模拟组织狭窄间隙的微流体装置已成为研究受限迁移过程中细胞动力学的重要工具,包括核变形和核膜破裂的后果.
细胞迁移是许多重要生理过程所必需的,包括免疫反应、伤口愈合和癌症转移。细胞迁移在癌症转移的背景下尤为重要,这是造成大多数癌症相关死亡的原因。对于转移的癌细胞,它们必须先从原发肿瘤部位迁移(侵袭),进入血液或淋巴管(内渗),通过这些血管或淋巴管将它们运送到身体的远处部位,然后离开血管(外渗)并迁移到新的位置,在那里它们可能会长成继发性肿瘤. 癌细胞的迁移行为是患者预后的良好指标,因为更多的迁移细胞以更高的速率形成转移。预防或减少癌细胞迁移可以显着改善癌症患者的预后,并且是降低转移相关死亡率的关键步骤。
在组织侵袭和渗入和渗出过程中,癌细胞必须挤过其他细胞之间和细胞外基质 (ECM) 内的小空间。近的研究结果表明,细胞核在细胞通过此类受限环境迁移过程中发挥着重要作用。细胞核是大和坚硬的细胞器,其变形决定了细胞通过小于核横截面的收缩的能力。与具有更多可变形细胞核的细胞相比,具有较少可变形细胞核的细胞通过微孔需要更长的时间. 核变形能力的主要决定因素之一是核纤层蛋白 A 和 C 的表达,它们是在内核膜下方形成致密蛋白网络(核纤层)的中间丝蛋白。有趣的是,核纤层蛋白 A/C 的表达在许多癌症中减少,这可能通过促进侵袭和内渗和外渗来增加肿瘤细胞的转移潜能。
除了通过受限环境调节转运效率外,通过狭窄空间的迁移也会对细胞核施加巨大的物理应力,这可能导致间期核膜 (NE) 完整性的短暂丧失,称为 NE 破裂。NE 破裂允许细胞质和核蛋白不受控制地交换,连同染色质突出到细胞质中,可能导致基因组不稳定性增加并促进癌症进展。细胞可以使用转运 III (ESCRT-III) 机制所需的内体分选复合物的成分恢复 NE完整性. 抑制 NE 修复,与抑制 DNA损伤修复途径相结合,会导致 NE 破裂后细胞死亡显着增加,这表明可以采用特异性靶向转移性癌细胞的潜在治疗方法。
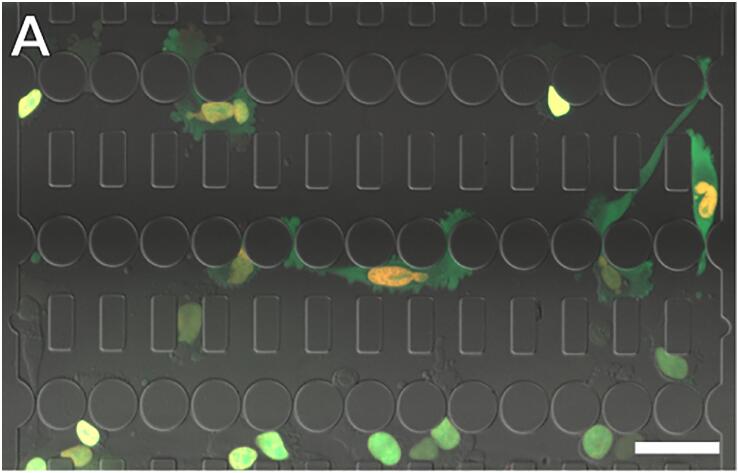
这些发现激发了人们对研究核变形和 NE 破裂的兴趣迅速增长,特别是在受限迁移期间。具有模拟体内间隙空间的定义收缩的微流体装置已成为研究核变形和 NE 破裂在细胞迁移中的作用的有力工具。尽管此类设备的壁比体内的更坚硬在这些微流体装置中获得的细胞迁移空间、受限迁移和 NE 破裂结果与在胶原基质和活体成像研究中获得的结果匹配,并且这些装置能够在的条件下对单细胞迁移进行延时成像定义的条件。在此类实验中,通常通过荧光标记的 DNA(例如,用 Hoechst 33342 染色)或组蛋白(例如,H2B-tdTomato 的表达)来识别细胞核。可以通过监测含有核定位序列 (NLS-GFP) 的绿色荧光蛋白的细胞内定位来检测 NE 破裂事件]. NLS-GFP 通常包含在细胞核内,但在 NE 破裂期间溢出到细胞质中,并在 NE 修复后逐渐重新导入细胞核(图 1 )。使用癌细胞的延时实验通常持续 6 到 24 小时,每 2 到 10 分钟采集一次多色(荧光和透射光)图像,从而产生大量(每个实验 >40 GB)多维数据集几天到几周的时间来手动分析。在研究大量实验条件时,这种低通量图像分析提出了巨大的挑战。此外,不同观察者的手动分析可以为实验数据增加很大的可变性。 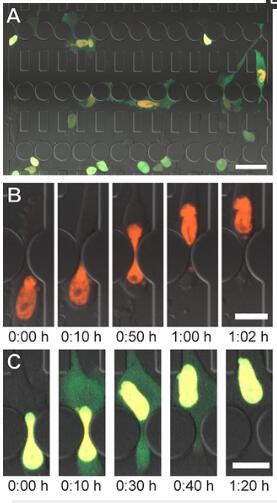
图。1(A) 表达NLS-GFP和H2B-tdTomato的细胞通过微流体装置迁移。比例尺:50um。(B) 细胞核挤压收缩的时间序列。比例尺:bar 20um。 (C) NE破裂事件的时间序列。NLS-GFP在NE破裂时泄漏到细胞质中,并在NE修复时重新导入细胞核。比例尺:20um。 系统重要性
该系统自动进行图像采集,自动进行通过孔隙的核转运和核包膜破裂等事件的相应延时序列的分析,不受不同人差异操作的影响。
自动图像分析程序来记录微流体收缩并执行图像分割以检测单个细胞核。跟踪核间的迁移,并记录收缩过境事件、过境时间、过境成功率和核包壳破裂。 这种自动化将分析迁移实验所需的时间从数周减少到数小时。收缩传输和核膜破裂都被正确可靠地检测到,并且自动分析结果与手动分析金标准匹配。
该系统能够检测具有不同水平的核包膜蛋白层粘连蛋白A/C(控制核变形能力)的细胞之间核转运时间的差异,并能够检测参与核包膜修复的蛋白CHMP7已被耗尽的 细胞中核膜破裂持续时间的增加。因此,该系统为研究受限迁移及其对细胞核的影响提供了一个通用的有力研究工具。
系统优势特点:
自动化、可重现且稳健的过程执行图像分析。该系统能够跟踪单个细胞/细胞核,因为它们通过微流体收缩通道迁移并计算单个收缩的传输时间。 虽然主要用于研究受限环境中的细胞迁移,但该系统也可用于研究在非受限二维基质上迁移的细胞。该系统还可以可靠地检测 NE 破裂事件及其持续时间。 该程序会自动识别分裂细胞,从而提高稳健性和准确性,可与专家手动分析相媲美,但效率大大提高。
密闭环境中细微肌肉迁移和核膜破裂的自动分析流程图(图 2):
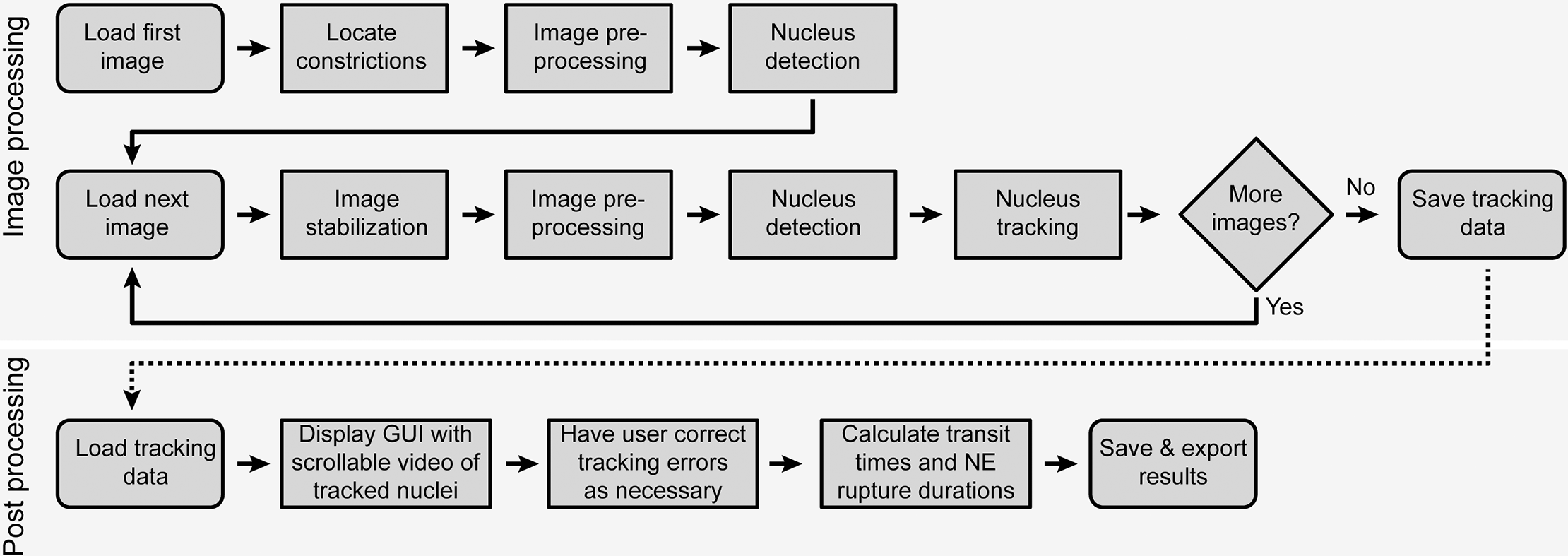
自动图像分析从定位一张图像中的收缩开始(图 2)。然后处理图像以减少噪声并检测荧光标记的细胞核。对于序列中的每个后续图像, 执行图像稳定以解决图像采集期间视野中的小偏移。然后对每个图像进行与上述相同的处理,以降低噪声并检测原子核。 已识别的细胞核从上一张图像到当前图像进行跟踪。然后观察所有细胞核的收缩通道和 NE 破裂的发生率。在分析完整序列后, 跟踪结果将导出到电子表格并呈现给用户进行手动验证
微流体迁移装置设计-微通道培养装置及定位收缩(收窄)
通过识别形成三排收缩的微流体装置中的圆柱来执行收缩位置(图 1A和图 S1)。这是通过对设备的透射光图像应用圆形霍夫变换(一种识别图像中圆圈的技术)来实现的。 然后旋转所有图像以水平对齐收缩行。虚拟边界定义在收缩中心线上方和下方的特定距离处,以确定每行收缩的核进入和退出 这些装置由一系列PDMS柱形成的平行迁移通道组成,细胞通过这些通道沿着趋化梯度迁移(图1)。通道可以用各种细胞外基质蛋白如胶原或纤连蛋白功能化以促进细胞粘附。 柱体形成的狭窄收缩模仿了细胞外基质和间隙中发现的2至30um宽的孔。趋化梯度是通过从大的源库穿过收缩通道扩散到汇库而建立的。两个储液器还通过一个250um高、1000um宽的旁通通道连接,为流体流动提供一条低阻力路径,在设备操作过程中出现不均匀填充或机械扰动的情况下,允许储液器之间的流体高度快速平衡。通过靠近收缩通道入口的两个250um高×300um宽的端口,将细胞直接接种到收缩通道口部的250um高处。在收缩通道之前和之后这些区域的增加的高度确保了细胞有足够的空间和充足的营养供应,同时便于容易装载;如果需要,也可以在通过收缩后收集细胞,例如,以分析成功通过收缩的细胞和保留在另一侧的细胞之间的基因表达差异。 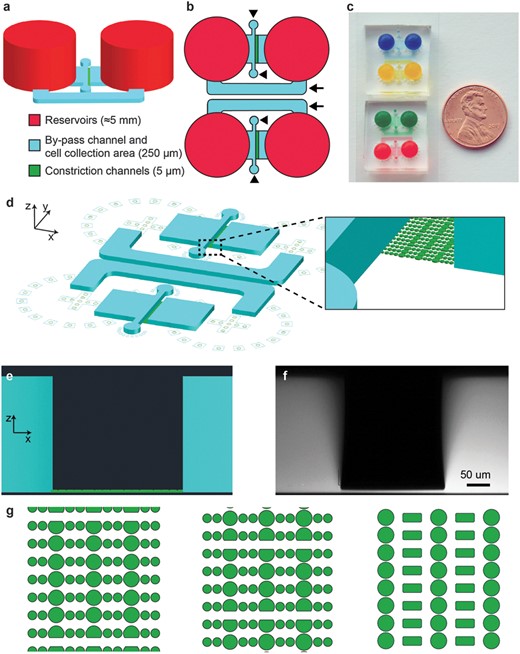
细胞微通道培养装置:
该设备包含一组细胞微通道培养装置,尺寸可变,细胞可以在其中迁移: 
PDMS 微通道已经绑定到 35 mm 玻璃底培养皿。 只需冲洗微通道,添加一些细胞外基质蛋白并加载您的细胞! > 准备好使用 您只需要一个移液器来装载您的细胞。 > 提供多种尺寸 从 3 到 1000um 宽度,适用于单细胞或集体迁移。 > 高质量的实时成像 玻璃底培养皿减少显微镜工作距离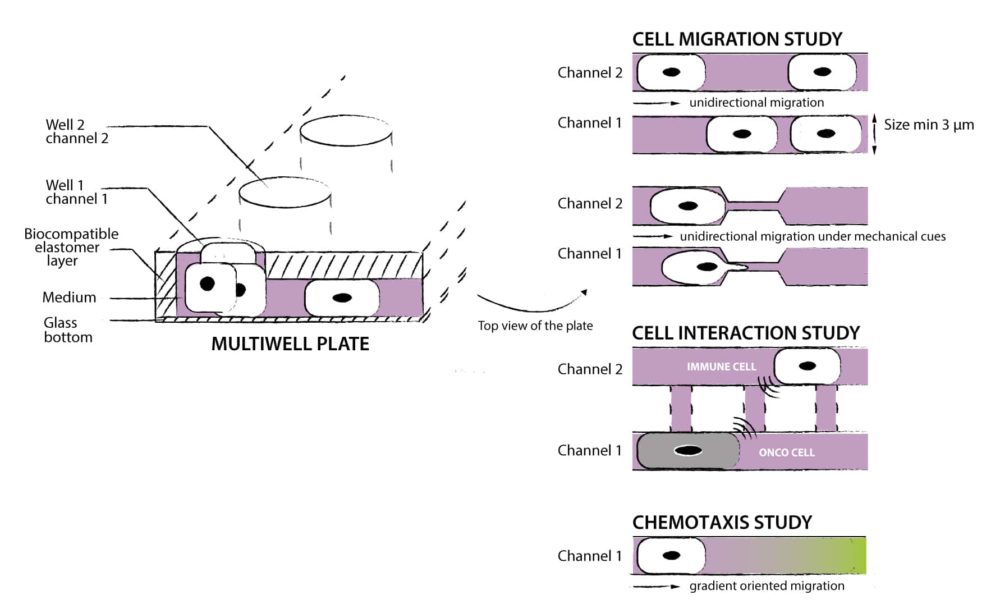 >沿长度方向宽度可变的通道(模仿自然收缩) >定制形状和尺寸 >适用于 35 毫米培养皿 >与高分辨率光学显微镜系统兼容 > 材质:聚二甲基硅氧烷 > 如果此设备不能满足您的需求,我们可以为您进行个性化定制 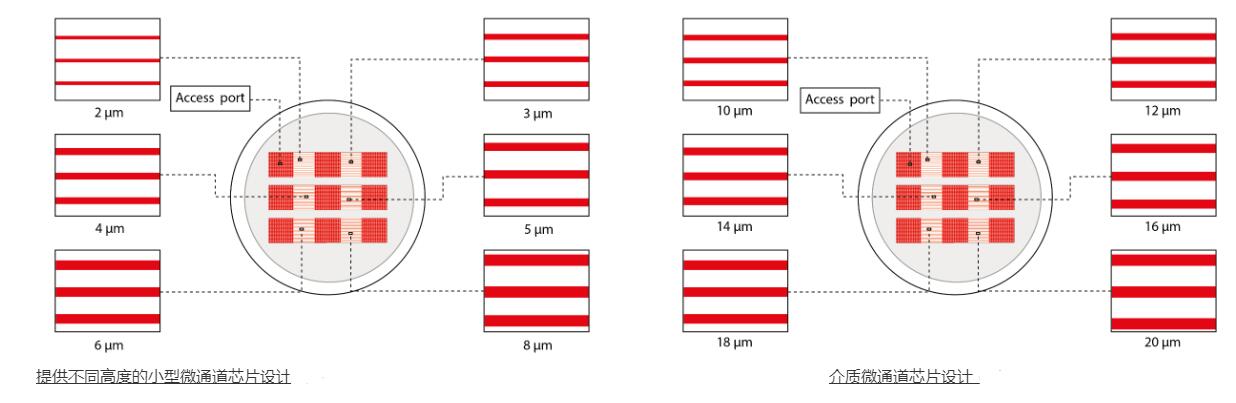

|