英文名称: Plasmid DNA mini Kit

核酸纯化柱无须平衡液处理,可最大吸附20 μg质粒DNA。 
特殊的添加中和指示剂设计,使初次使用者也可以获得最佳的质粒抽提效果。
20~30分钟内即可完成质粒DNA的制备,无须酚氯仿抽提。
起始细菌培养物用量:1-5 ml
用于分离纯化最多达20 μg分子生物学纯度级别的质粒DNA
·核酸纯化柱无须平衡液处理,可最大吸附20 μg 质粒DNA。
·特殊的添加中和指示剂设计,使初次使用者也可以获得最佳的质粒抽提效果。
·特别设计的Buffer W1 洗涤液,更彻底去除包括限制性内切酶在内的各种残留的蛋白,适用于包括野生型宿主菌在内的各种大肠杆菌菌株。
·20-30分钟内即可完成质粒DNA的制备,无须酚氯仿抽提。
·起始细菌培养物用量:1-5 ml。
·所需仪器:可适合2 ml离心管使用的离心机。
产品原理
在传统的碱裂解法抽提质粒的基础上,结合了柱纯化核酸技术,适合于从1~5 ml细菌培养物中提取多至20 μg高纯度质粒DNA。
操作步骤
细菌溶解后经离心沉淀细菌碎片及基因组DNA,所获得的含有质粒DNA 的上清液加入到纯化柱中,经过结合、清洗步骤去除杂质,质粒DNA即可被洗脱液或纯水洗脱下来。
1.测序
2.限制性酶切
3.连接与转化
4.体外转录/翻译5.强壮细胞转染
常见问题分析
1. 回收不到质粒DNA或者质粒DNA的回收效率低
可能的原因:
1) Buffer W2中未加入无水乙醇,应按比例补加无水乙醇。如果是错误地加入了其他试剂,请向我公司技术部寻求帮助。
2) Buffer W2中错误地加入了70%乙醇。请向我公司技术部寻求帮助。
3) 错误地使用了Buffer W1和Buffer W2的洗涤顺序。确保按正确的顺序洗涤纯化柱。
4) 质粒未转化到宿主菌中。确保从新鲜制备的含抗生素的平板中挑取单克隆菌落接种培养,并确保在培养基中加入对应的抗生素。
5) Buffer Ⅱ有白色沉淀产生。如有沉淀则应将Buffer II置于37℃水浴直至沉淀溶解后再使用。
6) Buffer Ⅱ使用完后未盖紧瓶盖,与空气长期接触导致溶菌效率下降。请制备新鲜的Buffer Ⅱ:1% SDS, 0.2M NaOH。
7) 菌体未悬浮充分。菌体未悬浮充分前勿加入Buffer Ⅱ。
8) DNA的洗脱效率差。参考第4页柱纯化技术中的第4点“洗脱质粒DNA”内容优化DNA的洗脱方案。
9) 分离纯化的是低拷贝质粒。适当增加细菌培养物的用量。
10) 细菌培养物中污染有真菌。确保从新鲜制备的含抗生素的平板中挑取单克隆菌落接种培养。
11) 质粒上插入的基因的表达产物对细菌有毒性,影响了细菌的正常生长。
2. 操作步骤中的异常现象:
1) 细菌沉积在管底,难以用漩涡振荡充分悬浮。如果要收集多达5ml细菌培养物,却仍然使用快速收集的菌体(12000 rpm 离心30秒)的方法,会导致收集的菌体难以悬浮,此时可尝试用移液器吸头吹打菌体沉淀的方法悬浮细菌;或者改为3000 rpm 离心5分钟收集菌体。
2) 加入Buffer Ⅱ后,溶液变得非常粘稠,无法流动。通常造成上述原因是细菌用量过多所至,会造成后续的中和步骤操作起来非常困难。但此时如果在Buffer Ⅰ中事先补加有中和指示剂,可在加入Buffer Ⅲ后持续翻转1.5 ml离心管直至溶液沉淀中的蓝色部分全部转换为淡黄色,以确保能达到合适的中和效果。
3) 加入Buffer Ⅱ后,溶液未呈现粘稠的半透明状,而是维持细菌在Buffer I中的浑浊状,无粘滞感。上述现象通常是因为细菌培养物中污染有大量的真菌,或者革兰氏阳性细菌等微生物所致。应确保从新鲜制备的含抗生素的平板中挑取单克隆菌落接种培养,而非用甘油菌接种。
4) 13000rpm 离心10分钟后沉淀不能沉积到管底,呈膨胀物的形式悬浮在液体中。通常是由于加入Buffer Ⅲ后未充分中和所致,请翻转离心管10次后再于13000rpm 离心10分钟。在Buffer I中事先补加中和指示剂,可以确保获得合适的中和效果。
5) 13000 rpm 离心10分钟后沉淀不能沉积到管底,贴在管壁,并伴有漂浮物浮在上清液表面。应怀疑Buffer Ⅱ使用完后未盖紧瓶盖而导致溶菌效果下降,请制备新鲜的Buffer Ⅱ:1% SDS, 0.2M NaOH。
6) 质粒DNA上样电泳时,加入上样孔的DNA溶液不能下沉,上浮飘散开来。通常是因为高速空离(操作步骤 8)没有操作,洗脱的质粒中乙醇含量过多所致。
3. 酶切失败
1) 限制性酶切后电泳质粒消失,没有条带,或者电泳条带出现严重的拖尾现象。可能是选用了野生型的或者是end A+的宿主菌所致,并且未用Buffer W1洗涤纯化柱。请确保用BufferW1洗涤纯化柱,或者按附录中的方法对质粒DNA作进一步的纯化。
2) 酶切不能完全切开。本试剂盒纯化得到的质粒DNA不存在酶切抑制物,可直接用于酶切(比如20 μl酶切体系中,除去2 μl 10×酶切缓冲液和1 μl限制性内切酶的体积后,可直接加入17 μl洗脱的质粒DNA用于酶切)。如果酶切不能完全切开,应尝试减少质粒DNA的用量,或者增加限制性内切酶的用量,并适当延长酶切时间。
4. 电泳质粒DNA电泳带型异常



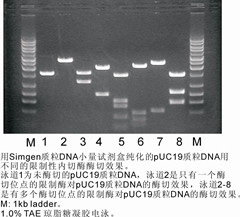
正常的质粒DNA带型,见图1:
C泳道:空载体pUC19电泳效果。顶部条带 1:二聚体质粒DNA;中间条带 2:含切口的质粒DNA;下部条带 3:超螺旋质粒DNA。
A泳道:空载体pUC19单酶切效果。
B泳道:含插入片段的pUC19双酶切效果。
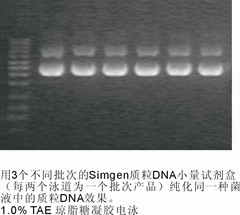
异常的质粒DNA带型,见图2:
获得的质粒DNA二聚体含量很高,或者纯化的质粒DNA于-20℃储存一段时间后二聚体增多(见图2泳道1)。质粒二聚体或者多聚体含量的增多与选择的宿主菌有关,但是质粒二聚体或者多聚体的存在并不影响质粒DNA酶切的电泳带型(见图2泳道2)。用TE溶液(10mM Tris-HCl, 1mMEDTA, pH 8.0)替代Buffer E或去离子水洗脱质粒DNA后储存于-20℃于有助于减少质粒二聚体的产生。
5. 质粒DNA中含有RNA污染
可能的原因:
Buffer Ⅰ中所含的RNase A活性降低。如果加入RNase A的Buffer Ⅰ在2~8℃保存的时间超过6个月,应补充RNase A至终浓度100 μg/ml。
6. 质粒DNA中含有细菌基因组DNA的污染
可能的原因:
1) 溶解步骤操作太剧烈:加入Buffer Ⅱ后应温和地翻转离心管使细菌溶解。
2) 溶解步骤停留时间过长:加入Buffer Ⅱ后静置时间不应超过5分钟。
3) 中和步骤操作太剧烈:加入Buffer Ⅲ后应温和地翻转离心管使溶液中和。
4) 细菌的培养时间超过16小时,导致部分细菌出现了溶菌现象。